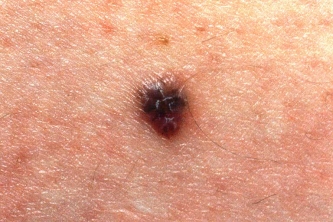
La FDA acelera la solicitud de un nuevo fármaco para melanoma inoperable o metastásico
La FDA realizará una evaluación con carácter prioritario con fecha de 28 de octubre, y la solicitud de autorización se revisará de conformidad con el programa de Autorización Acelerada de este organismo, después de haberle otorgado la denominación de Tratamiento Novedoso para el melanoma avanzado, el tipo más peligroso de cáncer de piel.
 En caso de ser aprobado por la FDA, este compuesto podría ser el primer anticuerpo anti-PD-1 en una nueva clase de moduladores de punto de control inmunitario.
En caso de ser aprobado por la FDA, este compuesto podría ser el primer anticuerpo anti-PD-1 en una nueva clase de moduladores de punto de control inmunitario.
"Esperamos que la FDA, a través de la revisión prioritaria de nuestra solicitud, permita que MK-3475 esté disponible para los pacientes con melanoma avanzado que no tienen otra opción de tratamiento", ha defendido Roger M. Perlmutter, presidente de Merck Research Laboratories.
El progreso en el avance del programa de desarrollo de MK-3475 está actualmente en curso en 30 tipos de tumores como monoterapia y como terapia combinada. Además, se ha anticipado que para finales de 2014 el programa de desarrollo de MK-3475 se incrementará a más de 24 ensayos clínicos en 30 tipos de tumores distintos, reclutando aproximadamente a 6.000 pacientes en cerca de 300 ubicaciones de ensayos clínicos en el mundo, incluidos cuatro nuevos estudios de fase III.
Asimismo, Perlmutter ha afirmado que, basándose en datos preclínicos favorables, se iniciará un estudio de rango de dosis en fase I con su anticuerpo agonista anti-GITR, MK-4166, en pacientes con tumores avanzados.
"Nuestra prioridad es desarrollar moléculas inmunomoduladoras que revelen la capacidad del sistema inmune para eliminar células cancerígenas. Aunque el MK-3475 proporciona una base sólida para la estrategia de investigación y desarrollo de MSD en el ámbito de la Oncología, también estamos desarrollando una amplia cartera de agonistas y antagonistas de control inmune", ha avanzado Perlmutter.
Fuente: pmfarma.com.mx, 16.05.14